MP Board Class 12 Chemistry Ideal and Non Ideal Solution
आदर्श एवं अनादर्श विलयन: राउल्ट के नियम के आधार पर वर्गीकरण
विलयनों का वर्गीकरण: आदर्श एवं अनादर्श विलयन
द्रव-द्रव विलयनों को राउल्ट के नियम के आधार पर आदर्श एवं अनादर्श विलयनों में वर्गीकृत किया जा सकता है।
1.5.1 आदर्श विलयन (Ideal Solutions)
ऐसे विलयन जो सभी सांद्रताओं पर राउल्ट के नियम का पालन करते हैं, आदर्श विलयन कहलाते हैं। आदर्श विलयन के दो अन्य मुख्य गुण भी होते हैं। मिश्रण बनाने के लिए शुद्ध अवयवों को मिश्रित करने पर:
- मिश्रण बनाने में एन्थैल्पी परिवर्तन (
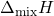 ) शून्य होता है। अर्थात्
) शून्य होता है। अर्थात् 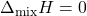 । इसका तात्पर्य यह है कि अवयवों को मिश्रित करने पर ऊष्मा का उत्सर्जन अथवा अवशोषण नहीं होता।
। इसका तात्पर्य यह है कि अवयवों को मिश्रित करने पर ऊष्मा का उत्सर्जन अथवा अवशोषण नहीं होता। - आयतन परिवर्तन (
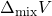 ) शून्य होता है। अर्थात्
) शून्य होता है। अर्थात् 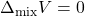 । इसके अतिरिक्त, विलयन का आयतन भी दोनों अवयवों के आयतन के योग के बराबर होता है।
। इसके अतिरिक्त, विलयन का आयतन भी दोनों अवयवों के आयतन के योग के बराबर होता है।
आण्विक स्तर पर विलयनों के आदर्श व्यवहार को अवयव A व B के अध्ययन द्वारा समझा जा सकता है। शुद्ध अवयवों में अंतराआण्विक आकर्षण अन्योन्यक्रियाएं A-A और B-B प्रकार की होती हैं। जबकि द्विअंगी विलयनों में इन दोनों अन्योन्यक्रियाओं के अतिरिक्त A-B प्रकार की अन्योन्यक्रियाएँ भी उपस्थित होंगी। यदि A-A व B-B के बीच अंतराआण्विक आकर्षण बल A-B के समान हों तो यह आदर्श विलयन बनाता है।
एक पूर्ण आदर्श विलयन की संभावना बहुत कम होती है, लेकिन कुछ विलयन व्यवहार में लगभग आदर्श होते हैं। n-हेक्सेन और n-हेप्टेन, ब्रोमोएथेन और क्लोरोएथेन तथा बेंजीन और टॉलुईन आदि के विलयन इस वर्ग में आते हैं।
1.5.2 अनादर्श विलयन (Non-Ideal Solutions)
जब कोई विलयन सभी सांद्रताओं पर राउल्ट के नियम का पालन नहीं करता तो वह अनादर्श विलयन कहलाता है। इस प्रकार के विलयनों का वाष्प दाब राउल्ट के नियम द्वारा प्रागुक्त (predict) किए गए वाष्प दाब से या तो अधिक होता है या कम।
- यदि यह अधिक होता है तो यह विलयन राउल्ट नियम से **धनात्मक विचलन (Positive Deviation)** प्रदर्शित करता है।
- और यदि यह कम होता है तो यह **ऋणात्मक विचलन (Negative Deviation)** प्रदर्शित करता है।
ऐसे विलयनों के वाष्प दाब का मोल-अंश के सापेक्ष आलेख, चित्र 1.6 में दिखाया गया है (चित्र यहाँ शामिल नहीं है, लेकिन मूल पाठ में इसका उल्लेख है)। इन विचलनों का कारण आण्विक स्तर पर अन्योन्यक्रियाओं की प्रकृति में स्थित है।
राउल्ट नियम से धनात्मक विचलन (Positive Deviation from Raoult’s Law)
राउल्ट नियम से धनात्मक विचलन की स्थिति में, A-B अन्योन्यक्रियाएं A-A अथवा B-B के बीच अन्योन्यक्रियाओं की तुलना में कमज़ोर होती हैं। अर्थात् इस स्थिति में विलेय-विलायक अणुओं के मध्य अंतराआण्विक आकर्षण बल विलेय-विलेय और विलायक-विलायक अणुओं की तुलना में कमज़ोर होते हैं। इसका मतलब इस प्रकार के विलयनों में से A अथवा B के अणु शुद्ध अवयव की तुलना में अधिक आसानी से पलायन कर सकते हैं। इसके परिणामस्वरूप वाष्प दाब में वृद्धि होती है जिससे धनात्मक विचलन होता है।
- उदाहरण 1: एथेनॉल व ऐसीटोन का मिश्रण शुद्ध एथेनॉल में अणुओं के मध्य हाइड्रोजन बंध होते हैं। इसमें ऐसीटोन मिलाने पर इसके अणु आतिथेय अणुओं के बीच आ जाते हैं, जिसके कारण आतिथेय अणुओं के बीच पहले से उपस्थित हाइड्रोजन बंध टूट जाते हैं। इससे अंतराआण्विक बल कमज़ोर हो जाने के कारण मिश्रण राउल्ट के नियम से धनात्मक विचलन दर्शाता है (चित्र 1.6 क का संदर्भ)।
- उदाहरण 2: कार्बन डाइसल्फाइड को ऐसीटोन में मिलाने पर बने विलयन में विलेय-विलायक अणुओं के मध्य द्विधुवीय अन्योन्यक्रियाएं विलेय-विलेय और विलायक-विलायक अणुओं के मध्य अन्योन्यक्रियाओं से कमज़ोर होती हैं। यह विलयन भी धनात्मक विचलन दिखाता है।
राउल्ट के नियम से ऋणात्मक विचलन (Negative Deviation from Raoult’s Law)
राउल्ट के नियम से ऋणात्मक विचलन की स्थिति में A-A व B-B के बीच अंतराआण्विक आकर्षण बल A-B की तुलना में कमज़ोर होता है। इसके फलस्वरूप वाष्प दाब कम हो जाता है अतः ऋणात्मक विचलन प्रदर्शित होता है।
- उदाहरण 1: फ़ीनॉल व ऐनिलीन का मिश्रण इस स्थिति में फ़ीनॉलिक प्रोटॉन व ऐनिलीन के नाइट्रोजन अणु के एकाकी इलेक्ट्रॉन युगल के मध्य अंतराआण्विक हाइड्रोजन बंध शुद्ध अणुओं के मध्य हाइड्रोजन बंध की तुलना में मज़बूत होता है।
- उदाहरण 2: क्लोरोफॉर्म व ऐसीटोन का मिश्रण यह मिश्रण भी ऐसा विलयन बनता है जो राउल्ट के नियम से ऋणात्मक विचलन दर्शाता है। इसका कारण यह है कि क्लोरोफॉर्म का अणु ऐसीटोन के अणु के साथ हाइड्रोजन बंध बना सकता है: H3C
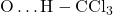 H3Cएसीटोन एवं क्लोरोफॉर्म के मध्य हाइड्रोजन बंध इसके कारण प्रत्येक घटक के अणुओं की पलायन की प्रवृत्ति कम हो जाती है, जिससे वाष्प दाब में कमी आ जाती है तथा राउल्ट नियम से ऋणात्मक विचलन होता है (चित्र 1.6 ख का संदर्भ)।
H3Cएसीटोन एवं क्लोरोफॉर्म के मध्य हाइड्रोजन बंध इसके कारण प्रत्येक घटक के अणुओं की पलायन की प्रवृत्ति कम हो जाती है, जिससे वाष्प दाब में कमी आ जाती है तथा राउल्ट नियम से ऋणात्मक विचलन होता है (चित्र 1.6 ख का संदर्भ)।
स्थिरक्वाथी (Azeotropes)
कुछ द्रव मिश्रित करने पर **स्थिरक्वाथी (Azeotropes)** बनाते हैं जो ऐसे द्विवटकीय मिश्रण हैं, जिनका द्रव व वाष्प प्रावस्था में संघटन समान होता है तथा यह एक स्थिर ताप पर उबलते हैं। ऐसे प्रकरणों में घटकों को प्रभाजी आसवन द्वारा अलग नहीं किया जा सकता। स्थिरक्वाथी दो प्रकार के होते हैं:
- न्यूनतम क्वथनांकी स्थिरक्वाथी (Minimum Boiling Azeotropes): विलयन जो एक निश्चित संगठन पर राउल्ट नियम से अत्यधिक धनात्मक विचलन प्रदर्शित करते हैं, न्यूनतम क्वथनांकी स्थिरक्वाथी बनाते हैं।
- उदाहरण: शर्कराओं के किण्वन से प्राप्त एथेनॉल एवं जल का मिश्रण प्रभाजी आसवन द्वारा जो विलयन देता है उसमें आयतन के आधार पर लगभग 95% तक एथेनॉल होती है। एक बार यह संघटन प्राप्त कर लेने के पश्चात्, जो कि स्थिरक्वाथी संघटन है, द्रव व वाष्प का संघटन समान हो जाता है तथा इसके आगे पृथक्करण नहीं होता।
- अधिकतम क्वथनांकी स्थिरक्वाथी (Maximum Boiling Azeotropes): विलयन जो कि राउल्ट नियम से बहुत अधिक ऋणात्मक विचलन दिखाते हैं, एक विशिष्ट संघटन पर अधिकतम क्वथनांकी स्थिरक्वाथी बनाते हैं।
- उदाहरण: नाइट्रिक अम्ल एवं जल का मिश्रण इस प्रकार के स्थिरक्वाथी का उदाहरण है। इस स्थिरक्वाथी के संघटन में लगभग 68% नाइट्रिक अम्ल एवं 32% जल (द्रव्यमान) होता है जिसका क्वथनांक 393.5 K होता है।
आदर्श एवं अनादर्श विलयन में अंतर निम्नलिखित हैं:
| विशेषता | आदर्श विलयन (Ideal Solutions) | अनादर्श विलयन (Non-Ideal Solutions) |
| राउल्ट का नियम | सभी सांद्रताओं पर राउल्ट के नियम का पालन करते हैं। | सभी सांद्रताओं पर राउल्ट के नियम का पालन नहीं करते। |
| एन्थैल्पी परिवर्तन (ΔmixH) | मिश्रण बनाने में एन्थैल्पी परिवर्तन शून्य होता है (ΔmixH=0)। | मिश्रण बनाने में एन्थैल्पी परिवर्तन शून्य नहीं होता (ΔmixH=0)। |
| आयतन परिवर्तन (ΔmixV) | मिश्रण बनाने में आयतन परिवर्तन शून्य होता है (ΔmixV=0)। | मिश्रण बनाने में आयतन परिवर्तन शून्य नहीं होता (ΔmixV=0)। |
| अंतराआण्विक बल | A-A और B-B के बीच अंतराआण्विक आकर्षण बल A-B के समान होते हैं। | A-B अन्योन्यक्रियाएं A-A या B-B से भिन्न होती हैं (या तो कमज़ोर या मज़बूत)। |
| वाष्प दाब | राउल्ट के नियम द्वारा प्रागुक्त वाष्प दाब के बराबर होता है। | राउल्ट के नियम द्वारा प्रागुक्त वाष्प दाब से या तो अधिक होता है (धनात्मक विचलन) या कम (ऋणात्मक विचलन)। |
| विचलन के प्रकार | कोई विचलन नहीं होता। | |
| धनात्मक विचलन: A-B अन्योन्यक्रियाएं A-A या B-B से कमज़ोर होती हैं। वाष्प दाब बढ़ता है। | ||
| ऋणात्मक विचलन: A-B अन्योन्यक्रियाएं A-A या B-B से मज़बूत होती हैं। वाष्प दाब घटता है। | ||
| उदाहरण | n-हेक्सेन और n-हेप्टेन, ब्रोमोएथेन और क्लोरोएथेन, बेंजीन और टॉलुईन के विलयन। | |
| धनात्मक विचलन: एथेनॉल व ऐसीटोन का मिश्रण, कार्बन डाइसल्फाइड व ऐसीटोन का मिश्रण। | ||
| ऋणात्मक विचलन: फ़ीनॉल व ऐनिलीन का मिश्रण, क्लोरोफॉर्म व ऐसीटोन का मिश्रण। |
पाठ्यनिहित प्रश्न 1.8 का हल: द्रव मिश्रण का संघटन और वाष्प प्रावस्था
पाठ्यनिहित प्रश्न 1.8 : 350 K पर शुद्ध द्रवों A एवं B के वाष्प दाब क्रमशः 450 एवं 750 mm Hg हैं। यदि कुल वाष्प दाब 600 mm Hg हो तो द्रव मिश्रण का संघटन ज्ञात कीजिए। साथ ही वाष्प प्रावस्था का संघटन भी ज्ञात कीजिए।
हल : दिया गया है:
- शुद्ध द्रव A का वाष्प दाब (
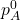 ) = 450 mm Hg
) = 450 mm Hg - शुद्ध द्रव B का वाष्प दाब (
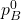 ) = 750 mm Hg
) = 750 mm Hg - कुल वाष्प दाब (
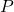 ) = 600 mm Hg
) = 600 mm Hg
(i) द्रव मिश्रण का संघटन (द्रव प्रावस्था में मोल-अंश)
राउल्ट के नियम के अनुसार, विलयन का कुल वाष्प दाब निम्न सूत्र द्वारा दिया जाता है:
![]()
हम जानते हैं कि द्रव प्रावस्था में मोल-अंश का योग 1 होता है:
![]()
![]() का मान राउल्ट के नियम के सूत्र में रखने पर:
का मान राउल्ट के नियम के सूत्र में रखने पर:
![]()
![]()
![]()
दिए गए मानों को सूत्र में रखने पर:
![]()
![]()
![]()
![]()
अब ![]() की गणना करें:
की गणना करें:
![]()
अतः, द्रव मिश्रण का संघटन है: ![]() और
और ![]() ।
।
(ii) वाष्प प्रावस्था का संघटन (वाष्प प्रावस्था में मोल-अंश)
डाल्टन के आंशिक दाब के नियम के अनुसार, वाष्प प्रावस्था में किसी अवयव का मोल-अंश (![]() ) उसके आंशिक दाब (
) उसके आंशिक दाब (![]() ) और कुल वाष्प दाब (
) और कुल वाष्प दाब (![]() ) का अनुपात होता है:
) का अनुपात होता है:
![]()
सबसे पहले, राउल्ट के नियम का उपयोग करके प्रत्येक अवयव के आंशिक दाब की गणना करें:
![]()
![]()
अब वाष्प प्रावस्था में मोल-अंश की गणना करें:
![]()
![]()
अतः, वाष्प प्रावस्था का संघटन है: ![]() और
और ![]() ।
।