MP Board 12th Physics Chapter 12 Atom Question Bank
अध्याय 12 परमाणु
स्मरणीय बिंदु –
1* परमाणु विद्युत का उदासीन होता है ।
2* थॉमसन मॉडल के अनुसार, परमाणु का समस्त द्रव्यमान लगभग 10-10 मीटर त्रिज्या के ठोस गोले में सीमित रहता है । तथा इसी में इलेक्ट्रॉन समान रूप में वितरित एवं स्थिर रहते है। इसे ‘प्लम-पुडिंग मॉडल’ भी कहा गया।
4* रदरफोर्ड के प्रयोग से यह स्पष्ट हुआ की नाभिक में धन आवेश इकठा रहता है,तथा इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगाते है। इसे ‘ग्रहीय मॉडल या नाभिकीय मॉडल’ भी कहा जाता है।
5* रदरफोर्ड के परमाणु मॉडल के अनुसार,
a) परमाणु उदासीन होता है।
b) परमाणु का समस्त द्रव्यमान और समस्त धनावेश उसके केंद्र में बहुत ही छोटे भाग में, (नाभिक में) संकेंदित रहते है।
c) इलेक्ट्रॉन नाभिक के चारों ओर किसी भी कक्षा में घूम सकते हैं।
6रदरफोर्ड के परमाणु मॉडल के दो दोष थे- (a) नाभिक के चारों ओर घूमते हुये त्वरित इलेक्ट्रॉनों को सर्पिलाकार गति करते हुए नाभिक की ओर चले जाना चाहिये। यह पदार्थ के स्थायित्व का खंडन करता है। (b) यह विभिन्न तत्वों के परमाणुओं के अभिलाक्षणिक लाईन स्पेक्ट्रम की व्याख्या नही करता। 7 नाभिक के पास जहाँ तक अल्फा कण पहुच जाते हैं,उसे ‘पहुच की निकटतम दूरी’ कहते है ।
इसका मान ![]()
जहाँ, Ze=नाभिक पर आवेश, m=अल्फा कण का द्रव्यमान, v= अल्फा कण का प्रारम्भिक वेग तथा ![]()
8* किसी इलेक्ट्रॉन की चाल उसके मुख्य क्वांटम नम्बर के व्युत्क्रमानुपाती होती है।
9* जब अल्फा-कण परमाणु से बहुत अधिक दूरी पर होते है , तब नाभिक के केंद्र से अल्फा-कण के वेग सदिश के बीच की दूरी को अल्फा-कण का संघट्ट प्राचल कहते है। इसे b से व्यक्त करते है। ![]()
![]()
10* किसी परमाणु के नाभिक से अल्फा-कण का संघट्ट प्राचल पर निर्भर करता है ।
(a) यदि संघट्ट प्राचल b का मान अधिक हो तो अल्फा-कण अविचलित हुए चले जाते है ।
(b) यदि संघट्ट प्राचल b का मान कम हो तो अल्फा-कण अधिक कोण से प्रकीर्णित हो जाते है।
(c) यदि संघट्ट प्राचल b=0 हो तो ![]()
![]()
11* प्रत्येक तत्व के परमाणु स्थायी होते है, और अभिलाक्षणिक स्पेक्ट्रम उत्पन्न करते है। स्पेक्ट्रम अलग- अलग समांतर रेखाओं का समुच्चय होता है, जिसे रेखिल वर्णक्रम कहते है। यह परमाणु संरचना के सम्बंध में महत्वपूर्ण सूचना देता है।
12* परमाण्विक हाइड्रोजन अनेक श्रेणी युक्त रेखिल स्पेक्ट्रम उत्सर्जित करता है। किसी श्रेणी में किसी रेखा की आवृत्ति को दो पदों के अंतर के रूप में व्यक्त किया जा सकता है।
लाइमन(Lyman) श्रेणी: ![]()
बामर(Balmer) श्रेणी: ![]()
पाशन(Paschen) श्रेणी: ![]()
ब्रेकेट(Bracket) श्रेणी: ![]()
फुंड(Pfund) श्रेणी: ![]()
13* परमाणुओं द्वारा उत्सर्जित रेखिल स्पेक्ट्रम तथा परमाणुओं के स्थायित्व की व्याख्या करने के लिये नील्स बोर ने हाइड्रोजनसम परमाणुओं (एकल इलेक्ट्रॉन) के लिये एक मॉडल प्रस्तावित किया। इसे ‘बोहर (नील्स बोहर) का परमाणु मॉडल’ कहते है। उन्होनें तीन अभिगृहित प्रस्तुत किये तथा क्वांटम यांत्रिकी की नीव रखी:
(a) किसी हाइड्रोजन परमाणु में कोई इलेक्ट्रॉन बिना विकिरण उत्सर्जित किये निश्चित कक्षा(स्थायी कक्षा) में परिक्रमण करते रहते है।
(b) स्थायी कक्षा वे होती है,जिनका कोणीय संवेग ![]()
(c) यदि कोई इलेक्ट्रॉन एक निश्चित कक्षा से निम्न ऊर्जावाली कक्षा में संक्रमण करता है तो एक फोटॉन उत्सर्जित करता है। यदि उत्सर्जित फोटॉन की आवृत्ति v हो तो, दोनो कक्षाओं की ऊर्जा का अंतर ![]()
14* कोणीय संवेग के क्वांटीकरण प्रतिबंध के परिणामस्वरूप, इलेक्ट्रॉन नाभिक की परिक्रमा केवल विशिष्ट त्रिज्याओं की कक्षाओं में ही करता है। हाइड्रोजन परमाणु के लिये इसका मान![]()
कुल ऊर्जा भी क्वांटित है: ![]()
15* डी-ब्रागली की परिकल्पना, कि इलेक्ट्रॉन की तरंगदैर्ध्य ![]()
16* बोहर का मॉडल हाइड्रोजनसम परमाणुओं (एकल इलेक्ट्रॉन) के लिये ही उपयुक्त है। अन्य किसी परमाणुओं के लिये विस्तारित नही किया जा सकता।
प्रत्येक प्रश्न में दिये गये विकल्पों में से सही विकल्प चुनकर लिखिये:
(i) परमाणु स्वंय में होता है-
(अ) धनावेशित
(ब) ऋणावेशित
(स) उदासीन
(द) धनावेशित और ऋणावेशित दोनो हो सकता है।
(ii) परमाणु का पहला मॉडल था-
(अ) ग्रहीय मॉडल
(ब) प्लम-पुडिंग मॉडल
(स) क्वॉन्टम मॉडल
(द) इनमें से कोई नही।
(iii) परमाणु का नाभिकीय मॉडल किसने दियो-
(अ) जे. जे. टॉमसन ने
(ब) नील्स बोहर ने
(स) अर्नेस्ट रदरफोर्ड ने
(द) जेकब बामर ने
(iv) जब कोई अल्फा-कण नाभिक के समीप आता है तो वह प्रकीर्णित हो जाता है, क्योंकि-
(अ) धनावेशित होने के कारण
(ब) ऋणावेशित होने के कारण
(स) नाभिक से टकराने के कारण
(द) भारी होने के कारण ।
(v) जब कोई अल्फा-कण नाभिक के समीप आता है तो वह प्रकीर्णित हो जाता है, क्योंकि-
(अ) गुरुत्वीय बल के कारण
(ब) चुम्बकीय बल के कारण
(स) क्षीण बल के कारण
(द) विद्युत बल के कारण
(vi) ऐल्फा कण है-
(अ) हाइड्रोजन परमाणु के नाभिक
(ब) हीलियम परमाणु का नाभिक
(स) रेडियोएक्टिव पदार्थो के नाभिक
(द) नियॉन परमाणु का नाभिक
(vii) नाभिक के खोजकर्ता हैं-
(अ) जे. जे. टॉमसन ने
(ब) नील्स बोहर ने
(स) अर्नेस्ट रदरफोर्ड ने
(द) जेकब बामर ने
(ix) हाइड्रोजन वर्णक्रम की बामर श्रेणी विद्युत चुम्बकीय वर्णक्रम के किस भाग में होती है-
(अ) पराबैंगनी
(ब) अवरक्त
(स) दृष्य प्रकाश
(द) रेडियो तरंग
(x) हाइड्रोजन परमाणु में इलेक्ट्रॉन का न्यूनतम कोणीय संवेग होगा-
(अ) ![]()
(ब) ![]()
(स) ![]()
(द) ![]()
(xi) ऐल्फा-कण प्रकीर्णन प्रयोग में ऐल्फा-कण का पथ होता है-
(अ) वृत्ताकार
(ब) परबलयाकार
(स) दीर्घवृत्ताकार
(द) अतिपरबलयाकार
(xii) इलेक्ट्रॉन की चाल अधिकतम होती है-
(अ) प्रथम कक्षा में
(ब) द्वितीय कक्षा में
(स) अंतिम कक्षा में
(द) सभी कक्षा में समान होती है।
सही जोड़ियाँ बनाइये
(A) खण्ड “अ” को खण्ड “ब” के साथ मिलाकर सही जोड़ी बनाइये :
(a) लाइमन श्रेणी
(b) बाल्मर श्रेणी
(c) पास्चेन श्रेणी
(d) ब्रैकेट श्रेणी
(e) फुंड श्रेणी
(i) ![]()
(ii) ![]()
(iii) ![]()
(iv) ![]()
(v) ![]()
(B) खण्ड “अ” को खण्ड “ब” के साथ मिलाकर सही जोड़ी बनाइये :
(a) लाइमन श्रेणी
(b) बाल्मर श्रेणी
(c) पास्चेन श्रेणी
(d) ब्रैकेट श्रेणी
(e) फुंड श्रेणी
(i) अवरक्त क्षेत्र
(ii) दूर अवरक्त क्षेत्र
(iii) अति-दूर अवरक्त क्षेत्र
(iv) पराबैंगनी क्षेत्र
(v) दृश्य क्षेत्र
रिक्त स्थानों की पूर्ति कर लिखिये
(i) इलेक्ट्रॉन की ऊर्जा …………. होती है। (धनात्मक / ऋणात्मक / शून्य)
(ii) प्रत्येक तत्व के रेखीय स्पेक्ट्रम में रेखाओं की संख्या …….. होती है। (निश्चित / अनन्त)
(iii) रेखीय वर्णक्रम …….. के सम्बन्ध में महत्वपूर्ण सूचना देता है। (परमाणु संरचना / प्रकाश के रंग)
(iv) परमाणु का आकार लगभग …….. होता है। ![]()
(v) परमाणु के औसत नाभिकीय का आकार का …….. गुना होता है। ![]()
(vi) परमाणु के स्थायित्व की व्याख्या …….. का मॉडल करता है। (द्रव्यांश / बोर)
(vii) हाइड्रोजन परमाणु के मूल कक्षा का त्रिज्या …….. Å० होती है। ![]()
(viii) निम्न कक्षा की अपेक्षा उच्च कक्षा में इलेक्ट्रॉन की गतिज ऊर्जा …….. होती है। (कम / अधिक)
(ix) निम्न कक्षा की अपेक्षा उच्च कक्षा में इलेक्ट्रॉन की स्थितिज ऊर्जा …….. होती है। (कम / अधिक)
(x) प्रत्येक परमाणु की ऊर्जा …….. होती है। (नियत / स्वेच्छिक)
प्रत्येक कथन का एक वाक्य/ शब्द में उत्तर दीजिए:
(i) पहली कक्षा में इलेक्ट्रॉन की ऊर्जा कितनी होती है?
(ii) दूसरी कक्षा में इलेक्ट्रॉन की ऊर्जा कितनी होती है?
(iii) तीसरी कक्षा में इलेक्ट्रॉन की ऊर्जा कितनी होती है?
(iv) अनंत कक्षा में इलेक्ट्रॉन की ऊर्जा कितनी होती है?
(v) रिडबर्ग नियतांक का मान बताइये?
अतिलघु उत्तरीय प्रश्न- (2 अंक)
- रदरफोर्ड के प्रयोग में प्रकीर्णन प्रक्रम के समय स्वर्ण – नाभिक स्थिर क्यों रहता है?
- गाइगर-मार्सडन प्रयोग में अधिकतर ऐल्फा-कण बिना विक्षेपित हुए बाहर क्यों निकल आते है?
- हाइड्रोजन स्पेक्ट्रम में बामर श्रेणी किसे कहते है?
- रिडवर्ग नियतांक का सूत्र, मान तथा मात्रक लिखिये।
- हाइड्रोजन परमाणु के वर्णक्रम में लाइमन श्रेणी की तरंगदैर्ध्य परास कहा से कहा तक होती है? यह विद्युत चुम्बकीय वर्णक्रम के किस क्षेत्र में पायी जाती है?
- हाइड्रोजन परमाणु के वर्णक्रम में बामर श्रेणी की तरंगदैर्ध्य परास कहा से कहा तक होती है तथा यह विद्युत चुम्बकीय वर्णक्रम के किस क्षेत्र में पायी जाती है?
- हाइड्रोजन परमाणु के वर्णक्रम में पाश्चेन श्रेणी की तरंगदैर्ध्य परास कहा से कहा तक होती है तथा यह विद्युत चुम्बकीय वर्णक्रम के किस क्षेत्र में पायी जाती है?
- हाइड्रोजन परमाणु के वर्णक्रम में ब्रैकेट श्रेणी की तरंगदैर्ध्य परास कहा से कहा तक होती है तथा यह विद्युत चुम्बकीय वर्णक्रम के किस क्षेत्र में पायी जाती है?
- हाइड्रोजन परमाणु के वर्णक्रम में फुंड श्रेणी की तरंगदैर्ध्य परास कहा से कहा तक होती है तथा यह विद्युत चुम्बकीय वर्णक्रम के किस क्षेत्र में पायी जाती है?
- रदरफोर्ड के परमाणु मॉडल तथा बोहर परमाणु मॉडल में अंतर लिखिये।
- ऐल्फा-कण प्रकीर्णन प्रयोग में स्वर्ण-पत्र झिल्ली को अत्यंत पतला (
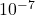
- गाइगर-मार्सडन प्रयोग में जिंक सल्फाइड की पर्त लगा पर्दे की क्या आवश्यकता थी?
- टॉमसन परमाणु मॉडल के दोष लिखिए।
- टॉमसन प्लम-पुडिंग मॉडल का नामांकित आरेख बनाइये।
- ऐल्फा-कण प्रकीर्णन प्रयोग के दो महत्त्वपूर्ण निष्कर्ष लिखिये।
- गाइगर-मॉर्सन प्रयोग का नामांकित सैंकेतिक आरेख बनाइये।
- बोहर मॉडल की परिकल्पनाएँ लिखिये।
- बोहर मॉडल की दो कमियाँ लिखिये।
- रदरफोर्ड मॉडल से नामिक के आकार का आकलन कैसे किया जाता है।