MP Board 10th Science Chapter 5 Classification of Elements
अध्याय 5: तत्वों का आवर्त वर्गीकरण
डोबेराइनर का त्रिक नियम (Dobereiner’s Triads)
परिचय:
डोबेराइनर का त्रिक नियम, जोहान्न वुल्फगांग डोबेराइनर द्वारा 1817 में प्रस्तावित, तत्वों के वर्गीकरण का प्रारंभिक प्रयास था। इसमें समान रासायनिक गुणों वाले तत्वों को तीन-तीन के समूहों (त्रिक) में व्यवस्थित किया गया।
नियम का सार:
बीच वाले तत्व का परमाणु द्रव्यमान अन्य दो तत्वों के परमाणु द्रव्यमान का औसत होता है।
उदाहरण:
लिथियम (![]() ), सोडियम (
), सोडियम (![]() ), पोटैशियम (
), पोटैशियम (![]() )
)
* लिथियम: परमाणु द्रव्यमान = 7
* पोटैशियम: परमाणु द्रव्यमान = 39
* औसत: ![]() (सोडियम का परमाणु द्रव्यमान)
(सोडियम का परमाणु द्रव्यमान)
सीमाएँ:
- सभी तत्वों पर लागू नहीं।
- केवल कुछ त्रिक बनाए जा सके।
- तत्वों की बढ़ती संख्या के कारण अप्रभावी।
न्यूलैंड्स का अष्टक नियम (Newland’s Law of Octaves)
परिचय:
जॉन न्यूलैंड्स ने 1864 में तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया और पाया कि हर आठवां तत्व पहले तत्व के समान गुण प्रदर्शित करता है।
नियम का सार:
तत्वों को परमाणु द्रव्यमान के क्रम में रखने पर हर आठवां तत्व पहले तत्व के समान रासायनिक गुण रखता है, जैसे संगीत में अष्टक स्वर।
उदाहरण:
* लिथियम (![]() ), सोडियम (
), सोडियम (![]() ), पोटैशियम (
), पोटैशियम (![]() ) – क्षारीय धातु।
) – क्षारीय धातु।
* फ्लोरीन (![]() ), क्लोरीन (
), क्लोरीन (![]() ) – हलोजन।
) – हलोजन।
लाभ:
- तत्वों को समूहों में व्यवस्थित करने का प्रारंभिक प्रयास।
- परमाणु द्रव्यमान आधारित पहला वर्गीकरण।
- हल्के तत्वों के लिए सटीक।
सीमाएँ:
- कैल्शियम (
 ) तक ही सही।
) तक ही सही। - कुछ तत्व (जैसे कोबाल्ट, निकेल) गलत स्थान पर।
- नए तत्वों के लिए स्थान नहीं।
मेंडलीव की आवर्त सारणी (Mendeleev’s Periodic Table)
परिचय:
दिमित्री मेंडलीव ने 1869 में तत्वों को परमाणु द्रव्यमान और रासायनिक गुणों के आधार पर व्यवस्थित किया।
मेंडलीव का आवर्त नियम:
तत्वों के भौतिक और रासायनिक गुण उनके परमाणु द्रव्यमान के आवर्त फलन होते हैं।
विशेषताएँ:
- तत्वों को समूहों और आवर्तों में व्यवस्थित।
- अज्ञात तत्वों के लिए स्थान छोड़ा।
- ऑक्साइड और हाइड्राइड के आधार पर वर्गीकरण।
भविष्यवाणियाँ:
- Eka-Boron → स्कैंडियम (
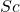 )
) - Eka-Aluminium → गैलियम (
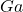 )
) - Eka-Silicon → जर्मेनियम (
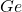 )
)
सीमाएँ:
- हाइड्रोजन (
 ) का स्थान अनिश्चित।
) का स्थान अनिश्चित। - आइसोटोप्स का समावेश नहीं।
- कुछ तत्वों (जैसे टेल्यूरियम, आयोडीन) का क्रम असंगत।
आधुनिक आवर्त सारणी से तुलना:
| विशेषता | मेंडलीव की आवर्त सारणी | आधुनिक आवर्त सारणी |
|---|---|---|
| आधार | परमाणु द्रव्यमान | परमाणु संख्या |
| तत्वों की संख्या | 63 | 118 |
| समूह और आवर्त | 7 समूह, 6 आवर्त | 18 समूह, 7 आवर्त |
| आइसोटोप्स | समायोजित नहीं | समायोजित |
आधुनिक आवर्त सारणी (Modern Periodic Table)
परिचय:
हेनरी मोसले द्वारा विकसित, यह तत्वों को परमाणु संख्या के आधार पर व्यवस्थित करती है।
आवर्त नियम:
तत्वों के गुण उनके परमाणु संख्या के आवर्त फलन होते हैं।
विशेषताएँ:
- संरचना: 18 समूह, 7 आवर्त।
- वर्गीकरण: धातु, अधातु, उपधातु।
- प्रवृत्तियाँ:
• परमाणु आकार: आवर्त में बाएँ से दाएँ घटता, समूह में ऊपर से नीचे बढ़ता।
• विद्युतऋणात्मकता: आवर्त में बढ़ती, समूह में घटती।
• आयनन ऊर्जा: विद्युतऋणात्मकता की तरह।
प्रश्न और उत्तर
प्रश्न 1: मेंडलीव की आवर्त सारणी का उपयोग कर निम्न तत्वों के ऑक्साइड के सूत्र का अनुमान लगाइए: 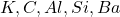
उत्तर:
* पोटैशियम (![]() ):
): ![]()
* कार्बन (![]() ):
): ![]() या
या ![]()
* एल्युमिनियम (![]() ):
): ![]()
* सिलिकॉन (![]() ):
): ![]()
* बैरियम (![]() ):
): ![]()
प्रश्न 2: गैलियम के अतिरिक्त, मेंडलीव ने किन तत्वों के लिए स्थान छोड़ा था? दो उदाहरण दीजिए।
उत्तर:
1. स्कैंडियम (![]() ) – Eka-Boron
) – Eka-Boron
2. जर्मेनियम (![]() ) – Eka-Silicon
) – Eka-Silicon
प्रश्न 3: मेंडलीव ने आवर्त सारणी के लिए कौन-सा मापदंड अपनाया?
उत्तर:
परमाणु द्रव्यमान के बढ़ते क्रम और रासायनिक गुणों की समानता।
प्रश्न 4: उष्मनकटिबंधीय गैसों को अलग समूह में क्यों रखा गया?
उत्तर:
उष्मनकटिबंधीय गैसें (![]() ) रासायनिक रूप से निष्क्रिय होती हैं। उनकी बाहरी कक्षा पूर्ण होने के कारण इन्हें समूह 18 में अलग रखा गया।
) रासायनिक रूप से निष्क्रिय होती हैं। उनकी बाहरी कक्षा पूर्ण होने के कारण इन्हें समूह 18 में अलग रखा गया।
प्रश्न 5: आधुनिक आवर्त सारणी ने मेंडलीव की विषमताओं को कैसे दूर किया?
उत्तर:
* परमाणु संख्या आधारित व्यवस्था से गलत क्रम (जैसे टेल्यूरियम, आयोडिन) ठीक।
* हाइड्रोजन और आइसोटोप्स के लिए उचित स्थान।
* उदक्षीण गैसों को समूह 18 में व्यवस्थित।
प्रश्न 6: मैग्नीशियम की तरह रासायनिक अभिक्रियाशीलता वाले दो तत्व।
उत्तर:
कैल्शियम (![]() ), बैरियम (
), बैरियम (![]() ) – समूह 2, समान रासायनिक गुण।
) – समूह 2, समान रासायनिक गुण।
प्रश्न 7: निम्न तत्वों के नाम:
(a) बाहरी कक्षा में 1 इलेक्ट्रॉन:![]() (क्षारीय धातु)।
(क्षारीय धातु)।
(b) बाहरी कक्षा में 2 इलेक्ट्रॉन:![]() (क्षारीय पृथ्वी धातु)।
(क्षारीय पृथ्वी धातु)।
(c) बाहरी कक्षा पूर्ण:![]() (उदासीन गैसें)।
(उदासीन गैसें)।
प्रश्न 8: लिथियम, सोडियम, पोटैशियम:
(a) रासायनिक गुणों में समानता?
हाँ, समूह 1 के तत्व, समान रासायनिक गुण, जल से ![]() मुक्त करते हैं।
मुक्त करते हैं।
(b) हीलियम और नियोन की संरचना में समानता?
दोनों की बाहरी कक्षा पूर्ण (![]() ), उदासीन गैसें।
), उदासीन गैसें।
प्रश्न 9: आधुनिक आवर्त सारणी के पहले दो स्तंभों की धातु:
उत्तर:
* समूह 1: ![]() (क्षारीय धातु)
(क्षारीय धातु)
* समूह 2: ![]() (क्षारीय पृथ्वी धातु)
(क्षारीय पृथ्वी धातु)
प्रश्न 10: सबसे अधिक धात्विक अभिलक्षण वाला तत्व: 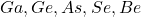
उत्तर:
गैलियम (![]() ) – सबसे नीचे और बाएँ, जहाँ धात्विकता अधिक होती है।
) – सबसे नीचे और बाएँ, जहाँ धात्विकता अधिक होती है।
प्रश्न 11: आवर्त सारणी में बाएँ से दाएँ और ऊपर से नीचे की प्रवृत्तियाँ:
उत्तर:
ऑक्साइड अम्लीय से क्षारीय होते हैं। विकल्प (d) सही।
प्रश्न 12: तत्व 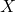 (
(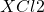 बनाता है) का समूह और आवर्त?
बनाता है) का समूह और आवर्त?
उत्तर:
मैग्नीशियम (![]() ) – समूह 2, आवर्त 3।
) – समूह 2, आवर्त 3।
प्रश्न 13: निम्न तत्वों की पहचान:
(a) दो कोश, प्रत्येक में 2 इलेक्ट्रॉन:
बेरिलियम (![]() ), विन्यास: 2,2।
), विन्यास: 2,2।
(b) विन्यास 2,8,2:
मैग्नीशियम (![]() )।
)।
(c) तीन कोश, बाहरी में 4 इलेक्ट्रॉन:
सिलिकॉन (![]() ), विन्यास: 2,8,4।
), विन्यास: 2,8,4।
(d) दूसरा कोश पहले से दोगुना:
कार्बन (![]() ), विन्यास: 2,4।
), विन्यास: 2,4।
प्रश्न 14: समान समूह के तत्वों के समान गुण?
उत्तर:
रासायनिक गुण, क्योंकि बाहरी कक्षा में इलेक्ट्रॉनों की संख्या समान।
प्रश्न 15: तत्व (विन्यास 2,8,8,1):
(a) परमाणु संख्या:
19, पोटैशियम (![]() )।
)।
(b) रासायनिक समानता:
फ्लोरीन (![]() ), क्योंकि
), क्योंकि ![]() हैलोजन से अभिक्रिया करता है।
हैलोजन से अभिक्रिया करता है।
प्रश्न 16: तत्व A, B, C (समूह 16: B; समूह 17: A, C):
(a) A धातु या अधातु?
अधातु (समूह 17)।
(b) C की अभिक्रियाशीलता?
A से कम, क्योंकि नीचे अभिक्रियाशीलता घटती है।
(c) B से आकार?
A और C छोटे, क्योंकि समूह 17 में नाभिकीय आकर्षण अधिक।
(d) A का आयन?
ऋणायन (Anion)।
प्रश्न 17: नाइट्रोजन (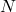 ) vs फॉस्फोरस (
) vs फॉस्फोरस (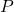 ) – अधिक अभिक्रियाशील?
) – अधिक अभिक्रियाशील?
उत्तर:
नाइट्रोजन, क्योंकि छोटा आकार और अधिक विद्युतऋणात्मकता।
प्रश्न 18: तत्वों की स्थिति के लिए इलेक्ट्रॉनिक विन्यास?
उत्तर:
परमाणु संख्या और बाहरी कक्षा के इलेक्ट्रॉन।
प्रश्न 19: कैल्शियम ( ) के समान गुण वाले तत्व:
) के समान गुण वाले तत्व: 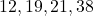
उत्तर:
मैग्नीशियम (![]() ), स्ट्रॉन्शियम (
), स्ट्रॉन्शियम (![]() – समूह 2।
– समूह 2।
प्रश्न 20: मेंडलीव vs आधुनिक आवर्त सारणी:
उत्तर:
| विशेषता | मेंडलीव | आधुनिक |
|---|---|---|
| आधार | परमाणु द्रव्यमान | परमाणु संख्या |
| समूह | 8 | 18 |
| रिक्त स्थान | हाँ | नहीं |
| उदासीन गैसें | अनुपस्थित | समूह 18 |